Топливо3
- 10.03.17, 11:08
Семен Смолин
Сейчас всеми изучается возможность использования переохлажденного кислорода либо кислорода в шугообразном состоянии, в виде смеси твердой и жидкой фаз этого компонента. Вид будет примерно такой же, как эта красивая ледяная шуга в бухточке правее Шаморы:
Пофантазируйте: вместо Н2О представьте ЖК (LOX).
Шугирование позволит увеличить общую плотность окислителя.
Пример захолаживания (переохлаждения) БР Р-9А: в качестве окислителя в ракете впервые было решено использовать переохлажденный жидкий кислород, что позволило уменьшить общее время подготовки ракеты к пуску и повысить степень ее боеготовности.
Примечание: почему-то за эту же самую процедуру нагибал (почти "чморил") Илона Маска известный писатель Дмитрий Конаныхин.
См:
В защиту макаронного монстра Илона Маска замолвим слово. Часть 1
В защиту макаронного монстра Илона Маска замолвим слово. Часть 2
Озон-O3
Плотность жидкости при -188 °C (85,2 К) составляет 1,59(7) г/см
Плотность твёрдого озона при 195,7 °С (77,4 К) равна 1,73(2) г/см
Температура плавления 197,2(2) °С (75,9 К)
Давно инженеры мучились с ним, пытаясь использовать в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике.
Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и Iуд. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 против 1,14 г/см соответственно), а его Т кипения выше (112 °C и 183 °C соответственно).
Пока непреодолимым препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по Iуд на близкие к предельным значениям параметры и для повышения УИ осталось лишь одна возможность, связанная с переходом на новые виды топлива.
Азотная кислота-HNO3
Состояние - жидкость при н.у.
Плотность=1,513 г/см
Т. плав.=-41,59 °C,Т. кип.=82,6 °C
HNO3 имеет высокую плотность, невысокую стоимость, производится в больших количествах, достаточно стабильна, в том числе при высоких температурах, пожаро- и взрывобезопасная. Главное ее преимущество перед жидким кислородом в высокой температуре кипения, а, следовательно, в возможности неограниченно долго храниться без всякой теплоизоляции. Молекула азотной кислоты HNO3 – почти идеальный окислитель. Она содержит в качестве “балласта” атом азота и “половинку” молекулы воды, а два с половиной атома кислорода можно использовать для окисления топлива. Но не тут-то было! Азотная кислота настолько агрессивное вещество, что непрерывно реагирует само с собой–атомы водорода отщепляются от одной молекулы кислоты и присоединяются к соседним, образуя непрочные, но чрезвычайно химически активные агрегаты. Даже самые стойкие сорта нержавеющей стали медленно разрушаются концентрированной азотной кислотой (в результате на дне бака образовывался густой зеленоватый «кисель», смесь солей металлов). Для уменьшения коррозионной активности в азотную кислоту стали добавлять различные вещества, всего 0,5% плавиковой (фтористоводородной) кислоты уменьшают скорость коррозии нержавеющей стали в десять раз.
Для повышения уд.импульса в кислоту добавляют двуокись азота (NO2). Добавка диоксида азота в кислоту связывает попадающую в окислитель воду, что уменьшает коррозионную активность кислоты, увеличивается плотность раствора, достигая максимума при 14% растворенного NO2. Эту концентрацию использовали американцы для своих боевых ракет.
Мы почти 20 лет искали подходящую тару для азотной кислоты. Очень трудно при этом подобрать конструкционные материалы для баков, труб, камер сгорания ЖРД.
Вариант окислителя, что выбрали в США, с 14 % двуокиси азота. А наши ракетчики поступили иначе. Надо было догонять США любой ценой, поэтому окислители советских марок – АК-20 и АК-27 – содержали 20 и 27 % тетраоксида.
Интересный факт: в первом советском ракетном истребителе БИ-1 были использованы для полетов азотная кислота и керосин.
Баки и трубы пришлось изготовлять из монель-металла: сплава никеля и меди, он стал очень популярным конструкционным материалом у ракетчиков. Советские рубли были почти на 95 % сделаны из этого сплава.
Недостатки: терпимая "гадость". Коррозионною активна. Удельный импульс недостаточно высок. В настоящее время в чистом виде почти не используется.
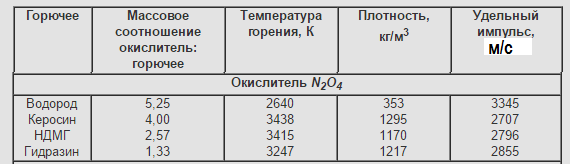
Азотный тетраоксид-АТ (N2O4)
Плотность=1,443 г/см
"Принял эстафету" от азотной кислоты в военных двигателях. Обладает саомовоспламеняемостью с гидразином, НДМГ. Низкокипящий компонент, но может долго хранится при принятии особых мер.
Недостатки: такая же гадость, как и HNO3, но со своими причудами. Может разлагаться на окись азота. Токсичен. Низкий удельный импульс. Часто использовали и используют окислитель АК-NN. Это смесь азотной кислоты и азотного тетраоксида, иногда её называют "красной дымящейся азотной кислотой". Цифры обозначают процентное кол-во N2O4.
В основном эти окислители используются в ЖРД военного назначения и ЖРД КА благодаря своим свойствам: долгохранимость и самовоспламеняемость. Характерные горючие для АТ это НДМГ и гидразин.
Фтор-F2
Атомная масса=18,998403163 а. е. м. (г/моль)
Температура плавления=53,53 К (219,70 °C)
Температура кипения=85,03 К (188,12 °C)
Плотность (для жидкой фазы), =1,5127 г/см
Химия фтора начала развиваться с 1930-х годов, особенно быстро - в годы 2-й мировой войны 1939-45 годов и после нее в связи с потребностями атомной промышленности и ракетной техники. Название "Фтор" (от греч. phthoros - разрушение, гибель), предложенное А. Ампером в 1810 году, употребляется только в русском языке; во многих странах принято название "флюор". Это прекрасный окислитель с точки зрения химии. Окисляет и кислород, и воду, и вообще практически всё. Расчеты показывают, что максимальный теоретический Iуд можно получить на паре F2-Be (бериллий)-порядка 6000 м/с!
Супер? Облом, а не "супер"...Врагу такой окислитель не пожелаешь.
Чрезвычайно коррозионною активен, токсичен, склонен к взрывам при контакте с окисляющимися материалами. Криогенен. Любой продукт сгорания также имеет почти те же "грехи": жутко коррозионны и токсичны.
Техника безопасности. Фтор токсичен, предельно допустимая концентрация его в воздухе примерно 2·10-4 мг/л, а предельно допустимая концентрация при экспозиции не более 1 ч составляет 1,5·10-3мг/л.
ЖРД 8Д21 применение пары фтор + аммиак давало удельный импульс на уровне 4000 м/с.
Для пары F2+H2 получается Iуд=4020 м/с!
Беда: HF-фтороводород на "выхлопе".
Стартовая позиция после запуска такого "энергичного движка"?
Лужа жидких металлов и прочих растворённых в плавиковой кислоте химических и органических объектов!
Н2+2F=2HF, при комнатной температуре существует в виде димера H2F2.
Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. А использованию его в ЖРД КА не реально из-за убийственной сложности хранения и разрушительного действия продуктов сгорания.
Всё то же самое относится и к остальным жидким галогенам, например, к хлору.
Фтороводородный ЖРД тягой 25 т для оснащения обеих ступеней ракетного ускорителя АКС "Спираль" предполагалось разработать в ОКБ-456 В.П. Глушко на базе отработанного ЖРД тягой 10 т на фтороаммиачном (F2+NH3) топливе.













Коментарі